Siete avances esperanzadores que redefinen el tratamiento de la demencia
Estos hallazgos, desde un análisis de sangre hasta mejoras en la administración de medicamentos, pueden conducir a un mejor diagnóstico y tratamiento de la afección que altera la memoria


Si usted es como muchas personas, es posible que esté ansioso por el riesgo de sufrir demencia a medida que envejece.
El riesgo de desarrollar demencia a lo largo de la vida después de los 55 años se estima en un 42 %, según un estudio realizado en 2025 con más de 15.000 participantes. Se estima que el número de estadounidenses que desarrollan demencia cada año aumentará de 514.000 en 2020 a aproximadamente un millón para 2060.
Sin embargo, se han producido avances prometedores en el diagnóstico y el tratamiento de la enfermedad de Alzheimer, que representa entre el 60 % y el 80 % de los casos de demencia, así como en la comprensión de las causas biológicas y el desarrollo de la demencia en general. Aproximadamente la mitad de los casos de demencia podrían prevenirse abordando los factores de riesgo conocidos, según un informe de la Comisión Lancet de 2024.
Con estos avances, es importante “pisar el acelerador y realmente acelerar este trabajo”, dijo Ronald Petersen, profesor de neurología y ex director del Centro de Investigación de la Enfermedad de Alzheimer en la Facultad de Medicina y Ciencias de Mayo Clinic.
Estamos viendo un “espectro” de desarrollos desde “el nivel de salud pública alto y de bajo riesgo hasta las terapias intensivas individuales de alto riesgo”, dijo Nick Fox, médico y profesor de neurología en el University College de Londres, donde dirige el Centro de Investigación de Demencia.
“Creo que estamos a punto de lograr un impacto significativo en la calidad de vida: en la esperanza de vida, no sólo en la esperanza de vida”, afirmó Petersen.
A continuación se presentan algunos de los avances más interesantes en la investigación y el tratamiento de la demencia en 2025.
1. Un análisis de sangre para detectar el Alzheimer

En mayo, la Administración de Alimentos y Medicamentos aprobó el primer análisis de sangre para detectar señales de placas beta amiloide y ovillos tau (las características biológicas de la enfermedad de Alzheimer) con una precisión de más del 90 por ciento.
“Creo que este biomarcador sanguíneo realmente revolucionará la forma en que diagnosticamos, quién puede ser diagnosticado y quién realiza el diagnóstico”, dijo Kristine Yaffe, profesora y vicepresidenta del departamento de psiquiatría de la Universidad de California en San Francisco.
Durante aproximadamente una década, los médicos podían medir la beta amiloide con neuroimagen PET o detectar indicios de formación de placa mediante una punción lumbar que recolecta líquido cefalorraquídeo. Sin embargo, “las tomografías PET son costosas y las punciones lumbares son invasivas”, afirmó Petersen.
El nuevo análisis de sangre puede ser administrado por un médico de atención primaria y representa lo que algunos llaman la “democratización de las pruebas diagnósticas de la enfermedad de Alzheimer”, añadió. Los expertos esperan que el análisis de sangre haga que el diagnóstico del Alzheimer sea más accesible, asequible y disponible en zonas donde de otro modo sería difícil recibir un diagnóstico clínico debido a la falta de especialistas médicos o equipos.
Casi al mismo tiempo que se aprobó el análisis de sangre, la Asociación de Alzheimer produjo la primera guía de práctica clínica diagnóstica utilizando evaluaciones sólidas de literatura científica e incorporando pruebas de biomarcadores basados en la sangre, dijo Heather Snyder, vicepresidenta sénior de relaciones médicas y científicas de la asociación.
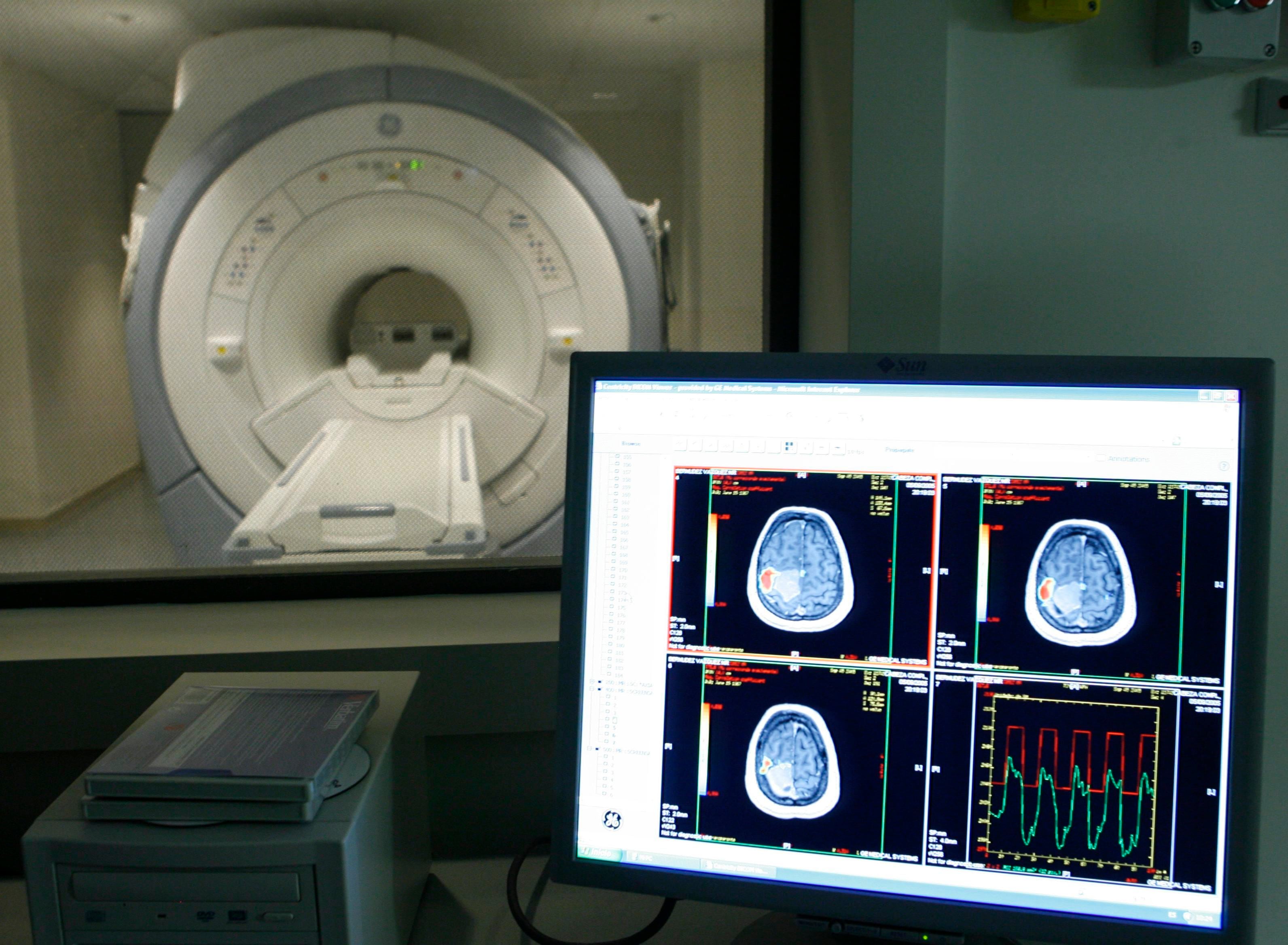
El análisis de sangre mide dos biomarcadores clave de la enfermedad de Alzheimer. Uno es la beta amiloide, una proteína que puede plegarse incorrectamente y crear placas pegajosas en el cerebro. El otro es p-tau217, una versión anormalmente modificada de la proteína tau que puede provocar la formación de ovillos disruptivos.
Se han estudiado muchos biomarcadores, pero “p-tau217 parece ser el más informativo con respecto a la probabilidad de que la persona tenga una biología subyacente de enfermedad de Alzheimer”, dijo Petersen.
Las investigaciones demuestran que el biomarcador p-tau217 puede servir como señal de alerta para el Alzheimer con años de antelación. La detección temprana implica mayores oportunidades para un tratamiento e intervención más tempranos, ya sea con medicamentos o cambios en el estilo de vida. La enfermedad de Alzheimer no tiene cura.
Si bien la acumulación de placas de beta amiloide y ovillos de tau es un sello distintivo del Alzheimer, un resultado positivo no significa necesariamente que la persona tenga o vaya a desarrollar Alzheimer. (Investigaciones han demostrado que más del 20 % de los adultos mayores de 65 años sin deterioro cognitivo son positivos para amiloide).
Las mejoras en los diagnósticos, incluido el análisis de sangre, también pueden ayudar a acelerar la investigación de tratamientos. Los ensayos clínicos dirigidos a procesos biológicos específicos pueden inscribir con mayor precisión a pacientes que tienen esos biomarcadores biológicos, dijo Petersen.
En el futuro, así como hacemos pruebas de rutina para el colesterol, podríamos hacer un análisis de sangre que cubra diferentes biomarcadores para crear nuestro perfil único para la demencia, que luego podría adaptarse para el tratamiento, dijo.
“Ahora hay cada vez más paneles que analizan múltiples proteínas simultáneamente”, dijo Fox. “Así que, si bien los biomarcadores sanguíneos representan un gran avance, no creo que estemos aún al final de su camino. Creo que habrá más mejoras y más cosas por venir”.
2. Mejorar la prestación del tratamiento del Alzheimer

Existen dos tratamientos para el Alzheimer aprobados por la Administración de Alimentos y Medicamentos (FDA) que actúan sobre la beta amiloide y la eliminan: donanemab y lecanemab. Estos tratamientos ralentizan la progresión del Alzheimer en aproximadamente un 30 %, lo que podría ayudar a muchos pacientes a lograr entre cuatro y seis meses de independencia funcional sostenida, afirmó Fox.
Sin embargo, sólo una pequeña proporción -alrededor de 1 de cada 1.000- de estas moléculas de medicamentos, administradas por vía intravenosa, llega al cerebro debido a la barrera hematoencefálica, dijo Fox.
“A menudo se habla del cerebro como una especie de frontera final, en parte por su inaccesibilidad”, afirmó. Por ello, es necesario administrar dosis más altas de fármacos antiamiloides, lo que puede provocar más efectos secundarios.
Pero los avances recientes pueden ayudar a que los tratamientos lleguen donde es necesario.
Los datos presentados en las conferencias de investigación sobre el Alzheimer en 2025 mostraron que un fármaco, el trontinemab, que utiliza tecnología de “lanzadera cerebral”, podría atravesar la barrera hematoencefálica y eliminar las placas amiloides con efectos secundarios reducidos.
Trontinemab, desarrollado por la empresa de atención médica Roche, funciona “aprovechando” el tratamiento antiamiloide en una molécula que se transporta naturalmente a través de la barrera hematoencefálica, dijo Fox.
“Es muy emocionante porque el principio se extenderá a otras terapias”, dijo Fox, quien ha sido consultor de Roche.
3. Terapia genética en el cerebro
También ha habido avances en otros tipos de demencia. En septiembre, un pequeño ensayo informó sobre el primer tratamiento exitoso para la enfermedad de Huntington, una enfermedad neurodegenerativa rara y devastadora que causa deterioro cognitivo, así como alteraciones del movimiento y del comportamiento.
La enfermedad de Huntington está causada por una mutación en un gen específico. El tratamiento experimental consiste en neurocirugía para infundir directamente una terapia génica en las áreas cerebrales afectadas, lo que produce una notable ralentización de la enfermedad: un 75 % en tres años, según la empresa de terapia génica uniQure.
El estudio es preliminar, se realizó en un número reducido de pacientes y no se publicó en una revista con revisión por pares. Sin embargo, “parece ser la primera vez que observamos una ralentización de la progresión de la enfermedad de Huntington”, afirmó Fox, quien no participó en el ensayo.
Disponer de terapias genéticas similares beneficiaría a otros pacientes con demencia, dijo Fox, que trabaja con pacientes con enfermedad de Alzheimer familiar hereditaria.
4. Mayor atención a la inflamación

Si bien la beta amiloide sigue siendo un objetivo de la investigación sobre la demencia, los científicos están investigando cada vez más el papel que desempeña la inflamación en el aumento del riesgo de demencia.
“El Alzheimer es una enfermedad compleja y probablemente no haya un único enfoque para tratarla”, afirmó Snyder.
De hecho, un estudio publicado en julio descubrió que las personas con el gen APOE4 comparten muchos cambios en su sistema inmunológico, lo que puede explicar su susceptibilidad no sólo al Alzheimer sino también a otras enfermedades neurodegenerativas.
La inflamación y la disfunción inmunológica afectan a muchos trastornos neurodegenerativos diferentes, incluida la demencia y el Parkinson.
“Creo que ahora se está dando un gran impulso a la inmunomodulación para el Alzheimer y otras enfermedades degenerativas”, dijo Yaffe, hablando sobre las formas de modificar la actividad del sistema inmunológico.
5. Las vacunas pueden reducir el riesgo de demencia

¿Una forma de modificar la actividad del sistema inmunitario relacionada con la reducción del riesgo de demencia? Las vacunas.
Recientemente, varios estudios a gran escala compararon los resultados de las personas que recibieron vacunas con los de las que no las recibieron.
Juntos, proporcionan evidencia sólida de que las vacunas podrían combatir el riesgo de demencia.
En abril, un estudio publicado en Nature realizó un seguimiento de más de 280.000 adultos en Gales y descubrió que la vacuna contra el herpes zóster redujo el riesgo de desarrollar demencia en un 20 % durante un período de siete años. En junio, otro estudio, que incluyó a más de 430.000 adultos, reveló que las vacunas contra el herpes zóster y contra el virus respiratorio sincitial (VRS) se asociaban con una reducción del riesgo de demencia.
Y en diciembre, un amplio estudio de seguimiento demostró que la vacuna contra el herpes zóster puede ralentizar la progresión de la demencia. La vacuna no solo redujo el riesgo de deterioro cognitivo leve en personas cognitivamente sanas, sino que también disminuyó la tasa de mortalidad en personas que ya padecían demencia.
Existen dos hipótesis biológicas generales que explican por qué las vacunas se relacionan con un menor riesgo de demencia. En primer lugar, las vacunas podrían reducir el riesgo de infecciones, que se han vinculado a un mayor riesgo de demencia. En segundo lugar, la propia vacuna podría activar el sistema inmunitario de forma beneficiosa.
Estos dos mecanismos no son mutuamente excluyentes y ambos pueden desempeñar un papel, dijeron los investigadores.
6. Las intervenciones en el estilo de vida pueden conducir a una mejor cognición

En julio, el mayor ensayo clínico de intervención en el estilo de vida en Estados Unidos reveló que la intervención simultánea en múltiples áreas (nutrición, ejercicio, entrenamiento cognitivo y monitorización de la salud) mejoró las medidas cognitivas de los participantes con riesgo de demencia. Los participantes del grupo más estructurado mejoraron más que los autoguiados.
El ensayo, conocido como US POINTER, fue “un gran momento” y “culmina décadas de investigación que realmente informaron la intervención”, incluido un ensayo previo de intervención en el estilo de vida realizado en Finlandia, dijo Snyder, uno de los autores del estudio POINTER.
Lo importante es que “existen formas de reducir los factores de riesgo de padecer Alzheimer y otras demencias” y “de hecho, se puede mejorar el perfil cognitivo del envejecimiento”, afirmó Yaffe, quien realizó un ensayo más pequeño sobre reducción de riesgos personalizada en 2024.
Por ejemplo, un estudio publicado en agosto sugirió que las personas que tienen un mayor riesgo genético de desarrollar Alzheimer porque son portadoras del gen APOE4 son las que más se benefician al seguir una dieta mediterránea.

Nuevos datos presentados en una conferencia sobre Alzheimer en diciembre mostraron una imagen más detallada de cómo las intervenciones estructuradas en el estilo de vida afectan la salud cerebral en diferentes subconjuntos de participantes del estudio principal.
Un estudio halló que los participantes del grupo estructurado mejoraron la regulación de la presión arterial, lo cual es importante para un flujo sanguíneo adecuado al cerebro. Otro estudio demostró que la intervención redujo las alteraciones respiratorias durante el sueño.
Un estudio de neuroimágenes no encontró diferencias en el volumen cerebral ni en los biomarcadores del Alzheimer, pero informó que las personas con mayor riesgo de padecer Alzheimer tuvieron mayores beneficios cognitivos gracias a la intervención estructurada en el estilo de vida.
La recopilación y el análisis de datos continúan, y se espera que el ensayo POINTER arroje más información.
7. Un vínculo recién descubierto con el litio

En agosto, un estudio publicado en Nature informó que el metal litio puede desempeñar un papel protector en el Alzheimer. “La idea de que el litio es neuroprotector existe desde hace tiempo”, dijo Yaffe, quien no participó en el estudio.
En un cerebro sano, el litio contribuye al buen funcionamiento de las neuronas. El carbonato de litio también se utiliza para tratar el trastorno bipolar.
El estudio, realizado en ratones, reveló que las placas de beta amiloide atrapaban el litio, lo que lo hacía menos efectivo. Además, un nivel bajo de litio generaba un entorno inflamatorio en el cerebro, caracterizado por una acumulación acelerada de placas de beta amiloide y ovillos de tau.
Los investigadores informaron que pequeñas cantidades de orotato de litio podrían revertir la enfermedad y restaurar la función cerebral, lo que apunta a una posible terapia interesante para probar en humanos.
“Creo que la justificación científica es convincente e interesante, pero necesitamos evaluarla realmente en el ensayo clínico para ver si podría ser terapéuticamente útil”, dijo Petersen.El progreso general que se está logrando en este campo puede estar cambiando el “enfoque nihilista hacia la demencia”, dijo Fox.
“Podemos hacer un diagnóstico definitivo en vida ahora. Podemos administrar terapias al cerebro. Podemos retrasar enfermedades”, dijo. “Estamos al principio, no al final de este camino”.
(c) 2026, The Washington Post
¿Cuál es tu reacción?